Qu’est-ce que l’ISO 13485:2016?
ISO 13485:2016 est une norme internationale pour le système de gestion de la qualité (SMQ) des organisations impliquées dans la industrie , la distribution, l’entretien et l’élimination des dispositifs médicaux. Les organisations certifiées ISO 13485:2016 sont reconnues pour produire des dispositifs médicaux conformes aux normes de l’industrie.
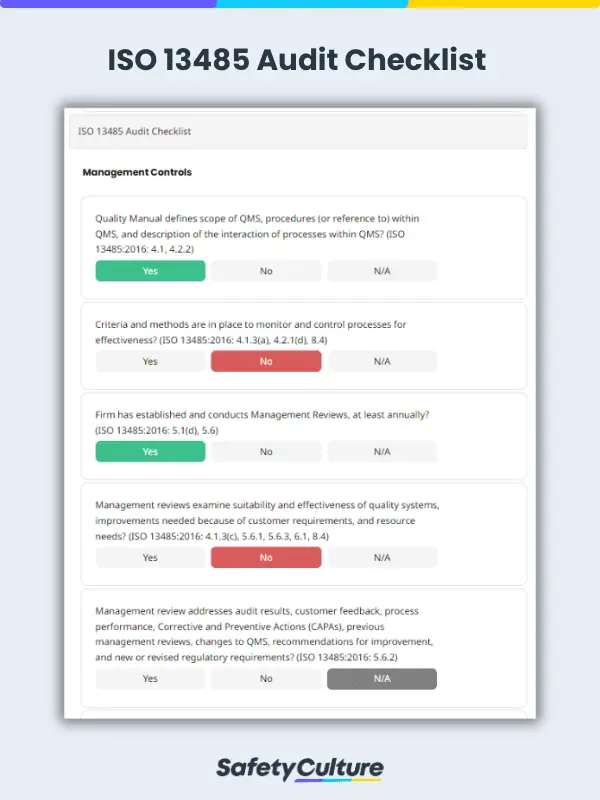
Qu’est-ce qu’une liste de contrôle d’audit ISO 13485 ?
Une telle liste de contrôle d’audit est un outil utilisé par les responsables de la qualité pour déterminer si la SMQ des organisations s’aligne sur la norme ISO. En effet, cette liste de contrôle est utile pour évaluer la préparation à un audit de certification par un tiers.
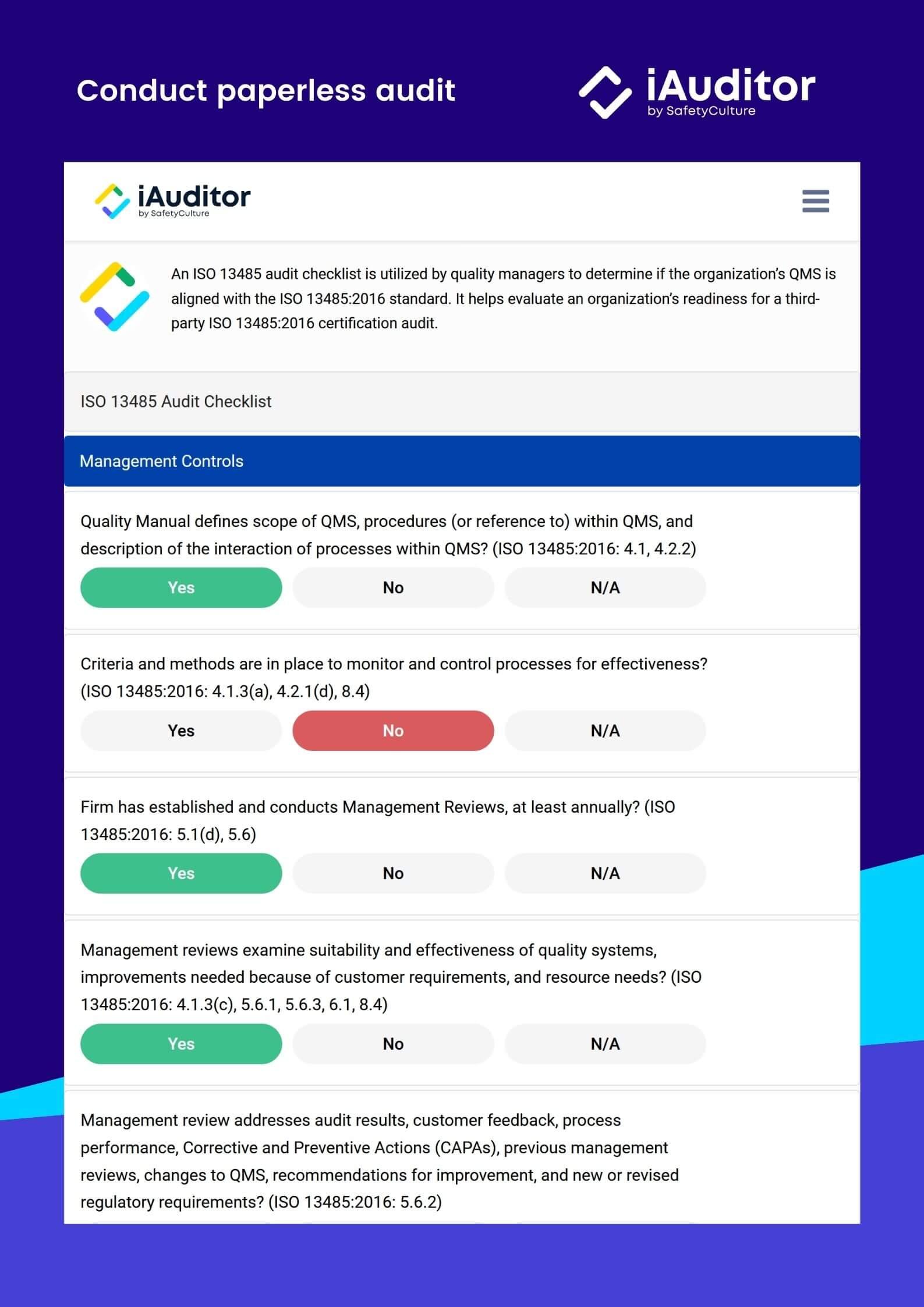
Liste de contrôle d’audit ISO 13485 | SafetyCulture (iAuditor)
5 étapes pour préparer à la certification ISO 13485
- Premièrement, obtenez une copie et comprenez la norme ISO 13485 : 2016 sur les dispositifs médicaux
- Ensuite, identifiez les domaines à améliorer dans le SMQ actuel en effectuant une analyse des lacunes ou un audit de préparation pour garantir le respect des exigences de la norme en question.
- Effectuez des audits de suivi de la qualité et conserver un enregistrement des résultats.
- Définissez par la suite, les compétences de votre entreprise et déterminer les exigences de formation pour la certification ISO sur la base des résultats de l’audit.
- Assurez-vous que les besoins en compétences sont satisfaits et que toutes les parties sont tenues au courant.
FAQ sur la norme ISO 13485
Bien qu’il ne soit pas nécessaire d’utiliser des listes de vérifications pour effectuer des audits ISO 13485, elles sont fortement recommandées en tant qu’outils utiles pour garantir la conformité à la norme. La liste de contrôle d’audit fournit une liste simple et détaillée d’éléments et d’aspects à vérifier dans le management d’une organisation, ce qui permet aux auditeurs de s’assurer plus facilement que tout est pris en compte.
La fréquence d’utilisation des listes de contrôle ISO 13485 dépend des besoins de l’organisation et des exigences internes. Certains peuvent choisir de mener des auto-évaluations à l’aide d’une liste de contrôle d’audit interne ISO 13485 périodiquement, par exemple une fois par an, tandis que d’autres peuvent l’intégrer à leurs processus de surveillance et d’amélioration en cours.
Un audit ISO 13485 est un processus d’évaluation approfondi qui permet aux organisations de garantir la conformité à la norme QMS actuelle pour la fabrication de dispositifs médicaux. Ce processus est effectué pour aider les entreprises à se préparer et à obtenir la certification ISO 13485.
Après l’obtention de la certification ISO 13485 initiale, des audits de surveillance réguliers sont menés au moins une fois par an pour assurer la conformité continue de l’organisation avec la norme. Les audits de recertification, quant à eux, sont réalisés tous les trois ans.
Des organismes d’audit tiers ou externes effectuent les audits pour la certification ISO 13485 proprement dite. Les audits initiaux, cependant, sont effectués par des auditeurs internes – principalement ceux de l’équipe d’assurance qualité – en vue des évaluations ultérieures plus formelles.